Olá galera,
Apesar de tantos experimentos estranhos, nunca ocorreu-me a idéia de fazer sabão por causa do sabão em si, achava algo tão banal e disseminado; mas o principal motivo é que eu achava o "fim de carreira" desperdiçar precioso NaOH simplesmente para fazer sabão caseiro.
Para mim um único e interessante aspecto da produção de sabão é a glicerina gerada no processo, que pode ser recuperada posteriormente (como as plantas industriais fazem), apesar da dor de cabeça que deve dar ter tanto trabalho para recuperar e purificar uma quantidade pequena de glicerina (idealmente, um mol de glicerina é produzido quando 1 mol de oleo e 3 de um alcali monobasico como o NaOH é usado). É o modo mais caseiro de produzir glicerina, e pode ser usado caso o produto comercial atual, puro , barato e atraente se torne no futuro uma merda de mistura, inconveniente para uso no homelab.
Uma vez, fiz sabão acidentalmente, enquanto tentava sintetizar biodisel usando óleo "anidro", etanol "anidro" e etóxido de sódio (etanol + NaOH)... Aparentemente ou os reagentes não estavam tão "anidros" assim ou então as condições reacionais não eram as melhores (pouco tempo de aquecimento, má agitação, etc)...Uma grande crosta de sabão se formou e se solidificou sob o etanol/óleo/glicerina residuais, dentro da garrafa de vidro usada.. A garrafa foi tampada e atualmente é efetivamente usada como enfeite do meu homelab ehehe
Outra vez , ainda pesquisando sobre biodiesel, tive a idéia de tentar reagir diretamente os ácidos graxos do sabão com o álcool (etanol, no caso), em presença de H2SO4 concentrado na esperança de produzir algum biodiesel.. O meio "quick'n'dirty" de fazer os acidos graxos foi reagindo o óleo com solução concentrada de NaOH, fazendo e separando o sabão formado e o reagindo com uma solução quente, na qual foi sendo adicionado lentamente acido sulfurico diluído para liberar o ácido graxo.. Essa etapa funcionou, mas infelizmente não consegui uma gota de biodiesel na outra parte do experimento.
Mas um dia, na falta do que fazer e com materiais em mãos, resolvi me distrair com essa prática inédita de fazer sabão.. Até que foi mais prazeiroso do que eu pensava..
Se você ainda não leu o texto que vem abaixo, então saiba que o presente artigo não é bem relacionado a sobre o que fazer para fazer um bom sabão, mas sim um artigo sobre o que você NÃO deve fazer para não cagar em seu sabão caseiro..eheh
======================================================================
Bom, o primeiro passo, de praxe, foi pesquisar na web alguma teoria e então algumas receitas 'caseiras'..
A teoria (bem superficial) é bem simples..
Os ésteres (didaticamente os compostos formados via um ácido orgânico e um alcool qualquer... Grande parte dos óleos estão inclusos nessa familia: óleos vegetais , gorduras animais, etc) reage, em geral com facilidade, com álcalis, "quebrando" o éster novamente em suas partes constituintes, o alcool e o ácido graxo (este fica na forma de sal, por reagir com o álcali)..
Mais formalmente, estas substâncias (óleos) são triglicerídeos que reagindo com álcali (por exemplo, uma base forte como NaOH, ou como fazem os mais antigos, usando cinzas de madeira (que contém material bastante alcalino - carbonatos de sódio e potássio)), é convertido em glicerina, que vai para a fase aquosa, e em sal do acido graxo, que pode ficar em solução ou ser precipitado por meios convenientes.. Este tipo de reação, onde uma base reage com um éster é conhecido como saponificação.. Muitas pessoas, quando ouvem falar, pensam logo em fabricação de sabão. O químico amador deve sempre lembrar que isso é apenas um tipo de reação e que a fabricação do sabão é apenas uma (e a mais famosa) delas.
Olhando algumas receitas na web, vi que a maioria misturava algum detergente no óleo antes de reagir com a soda caústica; isto é um truque bem interessante para a produção de sabão, já que faz com que o óleo se misture/emulsione na fase aquosa, aumentando muito a velocidade inicial da reação.
Depois era só dissolver toda a soda cáustica na água, e misturar com cuidado a mistura quente com o óleo "modificado" num balde por vários minutos, misturar com um pouco de etanol e verter num molde para que depois se solidificasse...
Outras versões de receitas caseiras usam salmoura concentrada para fazer o sabão precipitar da solução.
Resolvi seguir a receita com óleo/detergente..
O primeiro passo foi juntar o óleo velho que tinha aqui em casa.. Aproximadamente 3 litros de uma mistura de óleos de fritura. Visualmente um óleo bem velho e encronhento, o qual nem eu sei a origem e muito menos em que foi usado (certamente frituras dos mais variados naipes de comidas, tinha até um que fedia frango frito e que eu nem tive coragem de usar na experiência ahaha)...

Então um pouco de água torneiral foi aquecida e até pouco antes da fervura removida do fogo

Essa água foi então usada como "banho maria", para tornar a gosma de óleo e gordura menos viscosa (o que certamente tornou a filtração posterior bem mais rápida e eficaz)

Este óleo foi então filtrado usando uma garrafa, um funil de grande capacidade e um pedaço de tecido sintético (que eu cortei de uma roupa velha). O óleo era posto no filtro de tecido e o mesmo espremido com as mãos para acelerar a filtragem do óleo.. No final, após filtrar tudo, eu nem quis aproveitar o tecido, de tão necroso que estava eu joguei no lixo.

Na etapa seguinte, o óleo filtrado foi posto num balde, junto com algumas esguichadas de detergente e um pouco de sabão em pó e agitado ocasionalmente com um pedaço de cabo de vassoura...

Neste interím, eu quis bancar uma de "bonzão" : relembrei e apliquei a parte de derivada da matéria de cálculo I, através do famoso problema da caixa de máximo volume/mínima área.. Usando papelão de caixas de papelão coletadas numa loja próxima, resolvi fazer este cálculo por diversão e então montar as caixas..
Após os calculos, comecei a marcar com régua e a cortar sistematicamente tanto os pedaços de papelão

quanto os de papel manteiga

Fui gambiarrando daqui e dali, usando a vontade fita adesiva e progredindo na montagem...

Por fim, ao todo fiz 11 pequenas caixas de 10 cm x 20 cm x 2,1 cm , cobri com papel manteiga e depois fiz uma caixa maior com o resto do papelão que sobrou

Mas acabou que foi muito trabalho e no final ficaram uma merda as barras de sabão.. Poderia ter feito uma só caixa grande com papelão que recebesse todo o sabão, criando assim uma mega barra de sabão. Além disso, sobrou uma boa quantidade de retalhos de papelão e sujeira para eu limpar =[

A parte do medo veio em seguida...
1° Grande Erro: Aproximadamente 1,5 litros de água foi esquentada até perto da fervura , levada para fora e posta em outro balde, igual ao que estava a mistura de óleo e detergente.
Usando luvas , ~750g de soda cáustica 98% foram pesados e lentamente adicionados no balde com agua quente. A reação de dissolução do NaOH, sendo bastante exotérmica, fez a solução entrar em ebulição rapidamente no balde, liberando vapores nada amistosos aos pulmões. Fiquei longe e fui adicionando mais assim que a fervura baixava. Por fim, após um tempo consegui adicionar tudo sem que a mistura derramasse no chão. O meu erro aqui consistiu em não deixar a soda dissolver toda, deveria ter começado com água fria, no máximo esquentado até ficar ligeiramente morna, e especialmente ter mexido por mais tempo até sentir com o cabo de vassoura que tudo dissolveu... Mas NÃO!, o apressado aqui não esperou e foi jogando e mexendo o óleo na solução de NaOH.. Tive o pressentimento (tarde demais!) que se eu não dissolvi o NaOH residual na água não ia ser agora nessa mistura com óleo que o NaOH residual ia se dissolver.. E de fato não se dissolveu.
2° Grande Erro: Esse foi outro erro infantil que fechou com "chave de ouro" a produção do "sabão"..
Separei ~750mL de etanol hidratado comum (de farmácia) e desses, usei aproximadamente uns 300mL. Joguei lentamente esse alcool no balde com a mistura ainda muito quente e fui mechendo.. A mistura estava calma e pacífica e assim ficou por uns 30 segundos.. Após isso, de súbito a mistura cresceu de volume, cresceu tanto que grande parte estravazou do balde e criou uma bela situação de risco..

Com uma pá eu recolhi o material, que estava endurecendo por ter esfriado em contato com o chão frio, e joguei de volta ao balde..

Após o incidente, fiquei pensando no que poderia ter causado esse fato e cheguei a conclusão óbvia de que a mistura estava quente demais para a adição de etanol (estimando, bem acima no ponto de ebulição do alcool); este fervendo, liberou vapores que formaram inúmeras bolhas no material pastoso, fazendo-o aumentar muito de volume e estravazar do balde. Duvido muito que tenha acontecido outra coisa além disso.. No geral, naquelas condições, o etanol não reagiria quimicamente com o óleo e menos ainda com o NaOH (duvido que algum etóxido de sódio tenha se formado, havia bastante água no sistema).
A propósito, você pode estar se perguntando o que uma panela de pressão sem tampa e uma bacia pequena de plástico (azul) estão fazendo na figura acima. Usei a panela de pressão para aquecer a água do processo e a bacia pequena usei para receber temporariamente a soda cáustica.
ATENÇÃO não troque as bolas, em momento algum eu disse que esquentei no fogão alguma solução.. Esquentei APENAS água, que foi vertida no balde maior de plástico. Se você esquentar água numa panela comum (alumínio) e jogar soda cáustica, pode dar "adeus" a sua panela em instantes e possivelmente ao seu fogão também e dizer "oi" para uma situação de extremo risco: além do evento poder destruir sua cozinha, alguma parte dessa solução quente, tóxica e corrosiva podera cair/"voar" em você (com boas probabilidades de ir na sua cara, talvez nos olhos, te cegando), ainda vai gerar vastas quantidades de hidrogênio, um gás inflamável que com o ar pode formar misturas explosivas e uma atmosfera muito perigosa na sua cozinha. Portanto NUNCA deixe nada feito de alumínio entrar em contato com soda cáustica e outras substâncias sabidamente corrosivas.
Meio chateado, joguei todo o "sabão" nas formas

No outro dia, com luvas, tirei o material das formas e analisei sua textura.. por cima estavam bem escorregadios, indicando a presença de óleo livre (e dos outros lados estavam mais ainda, devido ao óleo liberado pelo papel manteiga), com cheiro estranho e cheio de escamas de soda cáustica, não dissolvida.. Estava basicamente igual a um "chokito" ("barra de sabão com flocos crocrantes de soda cáustica")..Além disso ainda continha um pouco de sujeira do chão (de parte do sabão que havia derramado no chão anteriormente)..A conclusão óbvia é de que CERTAMENTE eu não lavaria qualquer louça e muito menos tomaria banho com este sabão.. Limpeza pesada demais ehehe passe uma vez na sua pele e a "limpe" literalmente (ou seja, fique sem ela!)... ![]()
![]()
![]()
Bom, apesar do desperdício de reagentes, não foi uma experiência de todo ruim, foi até divertido (tirando a parte do clean-up)...Argh!!!!!! ![]()

Discussão dos Resultados
No procedimento de saponificação, a gordura/óleo é esquentada com a solução aquosa de NaOH sob forte agitação. O resultado é o glicerol (glicerina) e sais sódicos de ácidos graxos (sabão). Note que um mesmo óleo ou gordura pode conter esteres de vários tipos de acidos graxos.
C3H5(OR)3 + 3NaOH ![]() C3H5(OH)3 + 3 NaOR
C3H5(OH)3 + 3 NaOR
Gorduras contendo acidos graxos de baixo peso molecular (R com menos grupos metileno( -CH2-)) sofrem saponificação mais rápido que ácidos graxos de maior peso molecular.
A velocidade da saponificação é mostrada no gráfico abaixo que eu fiz no paint me baseando em um documento impresso da antiga página do frogfot[1] (www.frogfot.com) que infelizmente não existe mais.
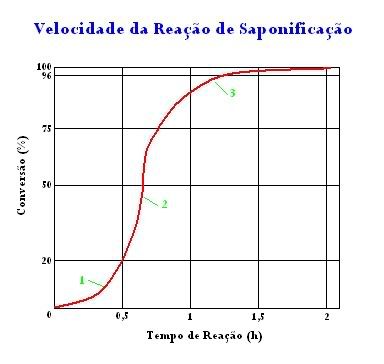
No início (1), a reação é lenta porque a mistura é heterogênea. Aqui, a velocidade depende de quão efetiva é a agitação (a agitação faz com que o óleo/gordura fique temporariamente emulsionado na solução. Quanto maior a agitação, mais fina se torna essa emulsão e quanto mais fina a emulsão, mais rápida é a reação devido a área superficial maior que emulsões mais finas proporcionam). Quando suficiente sabão é formado (2) (aprox. 20% de conversão), a velocidade da reação tem um aumento porque o sabão formado age como solvente da gordura (nesse ponto a emulsão começa a desaparecer para dar lugar a uma solução, ou seja, o sistema vai deixando de ser heterogêneo para se tornar homogêneo). Quando 80-85% da gordura é convertida (3) a velocidade abaixa novamente. Isso é devido ao fato de que a concentração de reagentes (NaOH e óleo/gordura) fica baixa, enquanto a concentração de produtos (sabão e glicerol) fica alta.
Na indústria são usadas diversas técnicas para reduzir o tempo reacional. Uma delas é adicionando sabão no início da reação, aumentando a velocidade em (1). Essa técnica é usada por muitas pessoas, que adicionam sabão e/ou detergente no início do procedimento - inclusive foi usado aqui também (algumas esguichadas de detergente na mistura inicial). O controle da temperatura é também importante (apesar de que é bem mais difícil de se fazer em casa). Pelo fato de que emulsões finas não são estáveis em temperaturas altas, o início da reação é realizado na indústria numa faixa de 60-80°C. Quando suficiente sabão é formado, a temperatura é aumentada para 100-105°C (maior a temperatura = maior a velocidade reacional).
De um modo simplificado, no final da reação, usualmente a solução com o sabão é precipitada com uma solução concentrada de NaCl (salmoura). Aguardando algumas horas se tem a separação entre a fase aquosa (glicerol, NaOH, NaCl e um pouco de sabão) e o sabão precipitado que flutua sobre a fase aquosa. O sabão pode ser re-dissolvido em água e re-precipitado novamente com NaCl(aq) para eliminar o NaOH e glicerina que ainda contém. Como foi dito, as soluções residuais contém glicerina, que é extraída. Primeiro essas soluções são neutralizadas (pois contém NaOH), concentradas por fervura até certo ponto, filtradas (para remover o NaCl e o sal da neutralização do NaOH) e então destilado a vácuo. A glicerina obtida pode ser destilada a vácuo novamente para se aumentar tanto sua concentração quanto sua pureza.
Alguns sabões são precipitados junto com a glicerina, que nem o "sabão" que eu fiz, mas com a diferença de que são consideravelmente mais alcalinos que os produzidos pela precipitação com salmoura. Uma purificação deste sabão com NaCl pode ser interessante para reduzir a alcalinidade, mas glicerina deve ser também adicionada.
Melhorias essenciais no processo falho que eu realizei seriam em primeiro lugar dissolver completamente toda a soda cáustica na água antes mesmo de pensar em misturar com o óleo/gordura. Talvez seja uma boa idéia dissolver a soda, com agitação e cuidado, (a soda na água, não a água na soda) numa quantidade mínima de água em um balde de plástico. O próprio calor da dissociação do NaOH faria a solução esquentar consideravelmente ao ponto de poder até ferver. Mesmo assim, se a soda não tiver se dissolvido completamente então um pouco de água fervente pode ser adicionada lentamente e com cuidado a mistura e então agitada até a dissolução do NaOH residual. A segunda melhoria talvez seja diminuir a quantidade de álcool etílico ou mesmo abolir esse alcool do processo produtivo do sabão. Outra melhoria seria no molde, que sem dúvida ia ser bem mais decente  .
.
Eu não tenho muitas esperanças em extrair a glicerina da produção do sabão, a não ser como última alternativa. Pela lógica e mesmo confirmação das descrições de amadores que já tentaram, tanto a extração quanto a purificação são muito trabalhosas e raramente tem bons rendimentos. Uma glicerina infinitamente mais fácil de extrair e de purificar é aquela derivada da produção de biodiesel. Mas infelizmente este assunto não será abordado aqui..
REFERÊNCIAS:
- [1] Frogfot Website (infelizmente esse link não funciona mais)
- [2] Handbook of Soap Manufacture - W.H. Simmons/H.A. Appleton - Scott, Greenwood & Son - 1908
ATENÇÃO:
Essa página e suas páginas derivadas contém informações que podem ser perigosas. Além disso eu não garanto a total acuracidade ou precisão das referidas informações contidas nelas. As informações contidas em todas as páginas e sub-páginas derivadas e interconectadas dessa página são de caráter genuína e puramente educacional. Eu NÃO me responsabilizo por nenhum dano e/ou fatalidade a indivíduos, ou dano a propriedade decorrente do mal uso das informações aqui contidas, pelo fato de as informações aqui contidas serem de caráter puramente educacional. Basta um mínimo de raciocínio lógico para compreender : NÃO é justo que eu e outros eventuais colaboradores dessa página e de suas subseqüentes ,assim como qualquer outro autor normal, tenha algum tipo de responsabilidade por qualquer acidente que alguém sofra por realizar (ou tentar realizar) qualquer um dos experimentos descritos. Isso é facilmente explicado pelo fato de que eu não ordenei ninguém que fizesse nada descrito aqui e muito menos tenho a capacidade "divina" de ler e ver a mente e a vida de todas as pessoas para saber o que estão fazendo. Portanto, em toda e qualquer hipótese, eu NÃO admito ter o mínimo de responsabilidade , de qualquer ato praticado por qualquer pessoa antes e/ou durante e/ou depois de ler , parcialmente ou totalmente, qualquer uma de minhas páginas.
INÍCIO |
======================================
======================================
======================================
DIGA NÃO A CENSURA NA INTERNET!
SEJA CONTRA O "PROJETO" DO SR. EDUARDO AZEREDO QUE VAI RIDIDULARIZAR A NOSSA INTERNET E RESTRINGIR E FERIR AINDA MAIS NOSSA (JÁ DÉBIL) LIBERDADE, ASSIM COMO NOSSOS DIREITOS!
PRA RIR OU CHORAR?