Carbonato de Cálcio - CaCO3
INTRODUÇÃO:
Um dos químicos de cálcio mais úteis para o químico amador de fim de semana, pois pode reagir com extrema facilidade com muitos ácidos (reage até mesmo o ácido carbônico, dando bicarbonato de Cálcio, Ca(HCO3)2, sal instável que só existe em solução e é beeeeeem mais solúvel que o "parente" carbonato).
O carbonato de cálcio pode também ser químicamente modificado por outras 'rotas' como por exemplo por meio do calor intenso (>900°C) pode ser convertido em óxido de cálcio (CaO), "cal virgem".
CaCO3 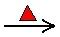 CaO + CO2(g)
CaO + CO2(g)
(lembrando que a reação pode ser reversível.. Em especial, se o sistema estiver fechado)
Essa reação é clássica em qualquer livro de ensino médio até porquê é uma das mais realizadas em escala industrial..Para as indústrias de construção civil por exemplo isto é VITAL (cal, Cimento, concretos,etc)... No home-lab e mesmo no laboratório "profissional" o CaO tem uma utilidade muito grande e é usado especialmente na secagem intensa de algumas substâncias líquidas como etanol e mesmo gases como a amônia e mesmo o ar.
Uma grande vantagem, especialmente para o químico amador 'iniciante' é de que o carbonato de cálcio é relativamente 'inofensivo'.. Você teria de ser muito burro para sofrer algum acidente com este sal..kkkkkkkkk Tanto é assim que o carbonato de cálcio entra na fórmula de vários medicamentos, inclusive orais, em especial aqueles recomendados para reposição de cálcio no organismo. Apenas para exemplificar, eu já usei um desses medicamentos (que logicamente estava vencido; portanto eu aproveitei ao invés de jogar fora) chamado "Ossotrat-D" ou coisa parecida (recipiente pequeno com vários comprimidos de 600mg de carbonato de cálcio mais vitamina D e outras coisas) na síntese de acetato de cálcio para posterior síntese de acetona. Apenas o fato do carbonato de cálcio poder servir como repositor de cálcio no organismo e portanto poder ser usado em remédio não significa que você pode ir jogando "qualquer" carbonato de cálcio na boca e engolir na esperança de 'fortalecer os ossos' ou dar qualquer outro efeito benéfico.. Aliás, nunca tenha idéias estúpidas como estas! Se o químico estiver com alguma impureza "fudida" como algumas substâncias tóxicas (inorgânicas ou mesmo orgânicas), e dependendo (em especial) da quantidade ingerida, pode dizer "tchauzinho"!!! Além disso, lembre-se que excesso de cálcio pode ocasionar em vários problemas, especialmente renais ('pedras nos rins', etc). Portanto, não brinque com a sua saúde!
Existem vários meios de se obter/fazer carbonato de cálcio.
Uma alternativa óbvia é comprar; vendem como "calcário". Muito usado, especialmente para corrigir o pH de solos (aumentar o pH e solos muitos acidos). Mas é bom ficar de olho muito aberto pois muitos "calcários" vendidos por ai são na realidade calcário dolomítico, que não é apenas carbonato de cálcio, mas sim uma espécie de sal duplo: carbonato de cálcio e magnésio (CaCO3*MgCO3) e que obviamente não tem as mesmas propriedades..
Os próprios medicamentos a base de CaCO3 (como dito antes) eu considero uma fonte de carbonato de cálcio, desde que o medicamento esteja vencido e você não tenha que pagar nada por ele.. Comprar isso na forma de medicamento (Haja GRANA!) é absolutamente INSANO, quando existem fontes infinitamente mais baratas de carbonato de cálcio (e relativamente puro)..
Sobre o giz escolar: encontrei muitas divergências no tocante ao giz escolar.. Você poderá encontrar muitas fontes e livros (ou mesmo na web) dizendo que o giz branco escolar é composto de carbonato de cálcio e outras fontes dizendo que é feito apartir de sulfato de cálcio. Segundo uma terceira fonte, existem os dois tipos: o giz de CaSO4 seria o giz 'normal' e o de CaCO3 seria do tipo anti-alérgico. Bom, um modo extremamente simples de diferenciar qual é qual é pegando um fragmento do giz a ser analisado e adicionar sobre ele algumas gotas de um ácido qualquer (mesmo ácidos "fracos" servem bem.. Vinagre / ou esprema metade de um limão em cima do giz: se o giz 'borbulhar' (soltar gás carbônico) significa que o material é feito de CaCO3 ou ao menos contém essa substância). Todos os 'tocos' de gizes escolares que eu já peguei quando eu ainda estudava no ensino médio, deles nenhum reagiu, nem com ácido muriático; sinal claro de que era mesmo sulfato de cálcio..Portanto ainda não tenho a confirmação realmente prática de que exista no Brasil algum tipo de giz escolar que seja mesmo a base de carbonato de cálcio; se alguém der a sorte de encontrar um desses, provavelmente poderá usar tranquilo em várias sínteses e experimentos que usem CaCO3 (lembrando ser sempre aconselhável usar o giz branco, pois o colorido é obviamente ainda mais impuro (pelo próprio "corante" usado ali))...Contudo, o carbonato de cálcio produzido pelo método abordado aqui reagiu com vigor mesmo com o suco de limão. Excelente sinal!!!
Sobre o giz "comum" de CaSO4: Talvez algumas marcas de giz nem mesmo sejam sulfato de cálcio, visto que também existem outras substâncias que, ao menos em tese, poderiam talvez ser usadas no lugar, como por exemplo silicato de magnésio hidratado, usado numa fórmula de giz anti-alérgico[1].
Concluindo sobre o giz escolar, na minha modesta opinião, não assuma que o giz que você possui ou viu escrito "anti-alérgico" é feito de (ou contém) carbonato de cálcio ANTES de fazer o simples teste do ácido descrito acima.. Feito isso, então tire suas próprias conclusões. =]
A síntese mais comumente vista nos livros é a de simplesmente borbulhar CO2 (g) na água com cal [Ca(OH)2] por algum tempo até todo o carbonato precipitar.. Eu particularmente não gosto tanto desse método por alguns motivos.. O primeiro deles é que a Cal vendida no mercado comum (no depósito de materiais de construção.. "cal extinta") não é exatamente cal.. Contém várias impurezas, em especial hidróxido de magnésio. Em segundo, você precisa de uma boa fonte de CO2 e muito barata para compensar.. Por exemplo, a fermentação anaeróbica de um liquido contendo algum tipo de açúcar gera basicamente CO2 e algum álcool (e mais várias impurezas) e isso apesar de gerar um fluxo fraco de gás carbônico, gera um fluxo que persiste por várias e várias horas, podendo chegar a dias ou mesmo semanas! Olhe o vídeo abaixo por exemplo:
"10 horas em 1 minuto e meio de fermentação":
Essa é somente uma das várias fontes de CO2 que existem e que poderiam ser usadas... Processos de combustão de matéria orgânica (queima de uma vela de parafina barata, por exemplo, num local semi-confinado, de tal modo que o ar com oxigênio entre, mas dentro deste local se crie uma atmosfera mais rica em CO2 que é então sugado em parte por uma bomba de aquário para a solução.. Eu já testei essa idéia com sucesso aqui. Mas tome cuidado se for tentar... Não faça isso dentro de casa ou ambientes fechados por dois motivos: riscos de incêndio e riscos de geração de monóxido de carbono (CO) altamente tóxico e que pode matar fácil!), gelo seco (bem mais caro),etc.. basta usar a imaginação..
Uma fonte direta e surpreendente de carbonato de cálcio, são cascas de ovos de galinha, que são compostas usualmente por 95% de CaCO3..(leia quadro abaixo e uma das referências para mais informações[2])..
| Substância , Nome "Popular", Fórmula e Estado Físico Em Que é Comumente Encontrada | Peso Molecular Aproximado | Informações Adicionais |
| Carbonato de Cálcio ( "Calcário" (não é o "calcário dolomítico" vendido nas lojas de adubo) - CaCO3(s)) |
100,1 | Algumas possíveis Fontes/rotas de obtenção:
***INFORMAÇÕES DE SEGURANÇA (Inglês)*** |
EXPERIMENTAL:
Nada de mais além de aproveitar algo que já estava praticamente "pronto" 
Apenas peguei os resíduos sólidos (filtrados) que sobraram da síntese de sulfato de sódio(veja esta seção para ver a reação e os métodos envolvidos) e após removê-los do papel filtro e jogá-los num recipiente de plástico alto e semi-transparente (usei um daqueles potes para armazenar 'fios' de macarrão), adicionei água fresca (da torneira) e lavei inúmeras vezes, sempre decantando e então eliminando a maior parte da fase aquosa e então adicionando mais água e repetindo inúmeras vezes esse ciclo na tentativa de livrar o carbonato de cálcio dos resquícios de sulfato de sódio e mesmo de parte do sulfato de cálcio não-reagido..No início desse ciclo de decantação, uma parte do carbonato de cálcio, extremamente fina (portanto, que praticamente não decantava ou que demorava muito para decantar) saia junto com a fase aquosa e portanto constituiu uma perda de rendimento no processo; contudo eu achei que que a perda de material por essa rota foi praticamente desprezível pois o material muito fino era muito pouco e além do mais cada vez que se repetia o processo, obviamente menos material super-fino vinha junto da parte aquosa, que era descartada. Isso geralmente acontece em quase todas as decantações que realizo, por exemplo, quando 'lavei' o óxido de cobre I e muitas outras substâncias.
No final dessas lavagens sucessivas, filtrei todo o CaCO3 novamente usando um filtro de papel grande e com cuidado lavei mais três vezes por sobre o filtro, adicionando água 'torneiral' por sobre o carbonato no filtro e então esperando a água lavá-lo e sair completamente; após isso adicionei mais água e repeti o processo (essa parte demora mais, mas vale a pena fazer pois ajuda ainda mais a eliminar os ultimos traços de outros sais, especialmente os de sódio solúveis.. Por essa razão é recomendado que se deixe a água de lavagem passar totalmente pelo filtro com o CaCO3 antes de adicionar mais água).
Após essas lavagens, o carbonato, junto com o próprio filtro de papel(que foi aberto) foram postos, e bem distrubuídos, em dois recipientes de plástico "rasos" para secar naturalmente ao ar... Dia após dia eram ocasionalmente 'remexidos' por um espeto de madeira (desses de churrasco)para expor novas superfícies da massa de CaCO3 e consequentemente acelerar o processo de secagem. A poeira do ar não foi grande problema pois em alguns dias o carbonato estava seco (bom, eu sequei o meu dentro de casa. Poderia ter secado fora, ao sol,para ir ainda mais rápido, mas não gosto muito dessa idéia.. De uma hora para outra pode chover e eu também posso esquecê-lo lá fora mesmo, além de ter uma preguiça enorme kkkkkkkk  )... Após isso, os mini-'blocos' quase totalmente secos de carbonato de cálcio que ainda existiam na massa foram esmagados e pulverizados com facilidade e então o pó resultante passado algumas vezes por uma peneira de cozinha de malha fina.. (o carbonato de cálcio não é coeso que nem o sulfato de cálcio (gesso)..Forma bloquinhos quando úmido, mas se a água, que é o agente aglutinador da massa ou "cimento" no caso, evapora, os bloquinhos ficam extremamente friáveis, "quebrando" e pulverizando fácil..). O pó então foi deixado secar ao ar por mais dois-três dias e então guardado num recipiente, que foi então rotulado (vide figura abaixo).
)... Após isso, os mini-'blocos' quase totalmente secos de carbonato de cálcio que ainda existiam na massa foram esmagados e pulverizados com facilidade e então o pó resultante passado algumas vezes por uma peneira de cozinha de malha fina.. (o carbonato de cálcio não é coeso que nem o sulfato de cálcio (gesso)..Forma bloquinhos quando úmido, mas se a água, que é o agente aglutinador da massa ou "cimento" no caso, evapora, os bloquinhos ficam extremamente friáveis, "quebrando" e pulverizando fácil..). O pó então foi deixado secar ao ar por mais dois-três dias e então guardado num recipiente, que foi então rotulado (vide figura abaixo).
RESULTADO:

Carbonato de cálcio em pó,'lavado', seco e pulverizado , no recipiente de Toddy (polipropileno), devidamente rotulado e que foi produzido como sub-produto da síntese de sulfato de sódio.
REFERÊNCIAS:
- [1] GIZ CERÂMICO MACIO, DURÁVEL E ANTIALÉRGICO E PROCESSO PARA PREPARAR O MESMO ; Patente Brasileira PI9503134
- [2] SMDB: Calcium Carbonate from Eggshells
ATENÇÃO:
Essa página e suas páginas derivadas contém informações que podem ser perigosas. Além disso eu não garanto a total acuracidade ou precisão das referidas informações contidas nelas. As informações contidas em todas as páginas e sub-páginas derivadas e interconectadas dessa página são de caráter genuína e puramente educacional. Eu NÃO me responsabilizo por nenhum dano e/ou fatalidade a indivíduos, ou dano a propriedade decorrente do mal uso das informações aqui contidas, pelo fato de as informações aqui contidas serem de caráter puramente educacional. Basta um mínimo de raciocínio lógico para compreender : NÃO é justo que eu e outros eventuais colaboradores dessa página e de suas subseqüentes ,assim como qualquer outro autor normal, tenha algum tipo de responsabilidade por qualquer acidente que alguém sofra por realizar (ou tentar realizar) qualquer um dos experimentos descritos. Isso é facilmente explicado pelo fato de que eu não ordenei ninguém que fizesse nada descrito aqui e muito menos tenho a capacidade "divina" de ler e ver a mente e a vida de todas as pessoas para saber o que estão fazendo. Portanto, em toda e qualquer hipótese, eu NÃO admito ter o mínimo de responsabilidade , de qualquer ato praticado por qualquer pessoa antes e/ou durante e/ou depois de ler , parcialmente ou totalmente, qualquer uma de minhas páginas.
INÍCIO |
======================================
======================================
======================================
DIGA NÃO A CENSURA NA INTERNET!
SEJA CONTRA O "PROJETO" DO SR. EDUARDO AZEREDO QUE VAI RIDIDULARIZAR A NOSSA INTERNET E RESTRINGIR E FERIR AINDA MAIS NOSSA (JÁ DÉBIL) LIBERDADE, ASSIM COMO NOSSOS DIREITOS!
PRA RIR OU CHORAR?

 ..Recomenda-se remover aquela "pelinha" da casca do ovo , secar e usar nos experimentos ou então fazer o seguinte: dissolver a casca do ovo (lavada) numa mínima quantidade de ácido muriático (HCl. Ou outro ácido que dê um sal de cálcio solúvel), filtre então a solução através de um papel filtro para remover as impurezas insolúveis e então basta adicionar uma solução concentrada de
..Recomenda-se remover aquela "pelinha" da casca do ovo , secar e usar nos experimentos ou então fazer o seguinte: dissolver a casca do ovo (lavada) numa mínima quantidade de ácido muriático (HCl. Ou outro ácido que dê um sal de cálcio solúvel), filtre então a solução através de um papel filtro para remover as impurezas insolúveis e então basta adicionar uma solução concentrada de  CaCO3 + Na2SO4).. Se notar bem, esse método não é nada a mais que uma variação do proposto acima (reação entre dois sais em meio aquoso para gerar dois outros sais, com um deles como carbonato de cálcio.. A diferença é que aqui um dos sais dos reagentes é muito pouco solúvel (sulfato de cálcio)..Leia mais nesta mesma página
CaCO3 + Na2SO4).. Se notar bem, esse método não é nada a mais que uma variação do proposto acima (reação entre dois sais em meio aquoso para gerar dois outros sais, com um deles como carbonato de cálcio.. A diferença é que aqui um dos sais dos reagentes é muito pouco solúvel (sulfato de cálcio)..Leia mais nesta mesma página